فلوسایتومتری (Flow Cytometry)
 فلوسایتومتری روشی دقیق و با کارایی بالا که برای شناسایی سلولها و ارزیابی ویژگی های آنها به كار میرود. این تکنیک بر اساس پراکنده سازی نور توسط سلولهای مورد آزمایش و انتشار فلورسانس از آنها استوار است. نشر فلورسانس با استفاده مستقیم از فلوروكرومهای متصل شونده به اجزای سلولی یا ترکیبی از رنگ فلورسنت با آنتی بادیهای مونوکلونال حاصل میشود. این آنتی بادیهای کونژوگه با فلورسانس میتوانند مولکولهای سطحی و یا ترکیبات داخلی سلولها را ردیابی کرده و به آنها متصل شوند و شناسایی انواع سلولهای موجود در یک جمعیت سلولی متنوع را توسط فلوسایتومتری امکانپذیر نمایند. فلوسایتومتری در بخشهای پژوهشی و در آزمایشگاههای تشخیصی كاربرد گسترده ای دارد و برای تشخیص و تعیین پیش آگهی بیماریها و همچنین برای ارزیابی درمان بدخیمیها استفاده می شود.
فلوسایتومتری روشی دقیق و با کارایی بالا که برای شناسایی سلولها و ارزیابی ویژگی های آنها به كار میرود. این تکنیک بر اساس پراکنده سازی نور توسط سلولهای مورد آزمایش و انتشار فلورسانس از آنها استوار است. نشر فلورسانس با استفاده مستقیم از فلوروكرومهای متصل شونده به اجزای سلولی یا ترکیبی از رنگ فلورسنت با آنتی بادیهای مونوکلونال حاصل میشود. این آنتی بادیهای کونژوگه با فلورسانس میتوانند مولکولهای سطحی و یا ترکیبات داخلی سلولها را ردیابی کرده و به آنها متصل شوند و شناسایی انواع سلولهای موجود در یک جمعیت سلولی متنوع را توسط فلوسایتومتری امکانپذیر نمایند. فلوسایتومتری در بخشهای پژوهشی و در آزمایشگاههای تشخیصی كاربرد گسترده ای دارد و برای تشخیص و تعیین پیش آگهی بیماریها و همچنین برای ارزیابی درمان بدخیمیها استفاده می شود.
اصول کلی فلوسایتومتری
در این روش، سلولهای رنگآمیزی شده (با استفاده از آنتیبادی مونوكلونال متصل به رنگ فلورسنت و یا فلوروكرومها) در یك جریان سیال قرار گرفته و به صورت تك تك از مقابل پرتوی نوری (لیزر) عبور میكنند. نور لیزر پس از برخورد به سلول یا در جهات مستقیم (forward scatter) و عمود بر محور تابش لیزر (side scatter) پراكنده شده و به آشکارساز میرسد و یا مربوط به فلوروكروم متصل به سطح ذره میباشد که در این صورت فلوروكرومهای متصل شده به سطح یا داخل سلول بر اثر تابش نور لیزر تحریک شده و انرژی نور تابیده شده را جذب كرده و سپس در طول موج دیگری به صورت تابش فلورسانس آزاد میکنند. پراكندگی نور در زاویههای مختلف میتواند سلولها را بر اساس تفاوت در اندازه و پیچیدگی درونی از هم متمایز كند، در حالی كه ساطع شدن نور فلورسانس از آنتیبادی نشاندار شده با فلورسنت میتواند سلولها را بر اساس تفاوت در آنتیژنهای سطحی و سیتوپلاسمی از هم تفكیك نماید. بدین ترتیب سلولها بر اساس خصوصیاتی نظیر حجم، گرانولاسیون و میزان رنگ پذیری از هم افتراق داده میشوند.
دستگاه فلوسایتومتر نوع و میزان فلورسانس و همچنین درجه و یا مسیر پراکنده شدن پرتوهای نوری را اندازه گیری می نماید. متعاقب اندازه گیری و آنالیز پارامترهای بدست آمده از سلول و یا ذره عبوری از مقابل پرتوهای نوری، اطلاعاتی از اندازه، شکل، ساختار سلول و یا ذره مورد مطالعه بدست می آید. همچنین اگر سلول و یا ذره با یک یا چند رنگ فلورسانس (فلوروکروم یا فلوروفور) رنگ آمیزی شده باشد پرتوهای نوری، این رنگ ها را برانگیخته و بدین شکل علاوه بر یافته های بدست آمده از اندازه و ساختار سلول، اطلاعاتی در ارتباط با فعالیت متابولیکی، محتوای DNA، حضور شاخص های اختصاصی سطح و یا داخل سلول نیز حاصل خواهد آمد. اجزای دقیق نوری و الکترونیکی دستگاه فلوسایتومتر، سیگنالهای فلورسانس و پرتوهای نوری پراکنده را توسط لنزهای مناسب جمع آوری نموده، سپس با استفاده از فیلتر های مناسب هر یک از سیگنال های نوری به سوی آشکارساز مناسب هدایت می شود. آشکارسازها سیگنال های نوری را به سیگنال های الکتریکی (متناسب با نور جمعآوری شده) تبدیل نموده و سپس سیگنال های اخیر توسط نرم افزار پردازش و آنالیز می گردد. البته بعضی از دستگاه های فلوسایتومتر مجهز به شناسایی و جداسازس سلولها و ذرات نیز می باشند. بعضی از این جداسازهای سلولی
می توانند ۷۰ هزار سلول را در ثانیه شناسایی و در لوله های جداگانه جداسازی نمایند.

فلوروکروم های مورد استفاده در فلوسایتومتری
تعداد فلوروكرومهای مورد استفاده در فلوسایتومتری طی سالیان متمادی در حال افزایش بوده است. شناخت انواع فلوروكرومها و آگاهی از مزیتها و معایب آن ها، تنها راه استفاده بهینه برای دستیابی به مقاصد علمی- تحقیقاتی می باشد. امروزه انوع مختلفی از فلوروکروم ها برای رنگ آمیزی سلولها و اجزای داخلی آنها مورد استفاده قرار می گیرند. رایجترین فلوروکروم ها یی که در فلوسایتومتری استفاده می شوند، Fluorescein Isothiocyanate) FITC) و Phycoerythrin) PE) می باشند. این رنگهای فلوئورسانس در محدوده ۴۸۸nm طیفهای جذبی دارند. بنابراین یك طول موج تحریكی لیزری، میتواند این دو رنگ را تحریك كند.دستگاههای فلوسایتومتراولیه قادر بودند فقط یك یا دو رنگ فلورسانس را تجزیه و تحلیل قرار دهند اما امروزه دستگاههایی عرضه شدهاند كه می توانند یازده رنگ فلورسانس را به طور همزمان شناسایی و پردازش نمایند. پیشرفتهای همزمان در وسایل، تولید آنتیبادیهای مونوكلونال، رنگهای فلوئورسانس، كامپیوتر و نرمافزار، دریچه ی جدیدی جهت استفاده از تكنیك فلوسایتومتری، در آزمایشگاههای كلینیكی گشوده است.

اجزای اصلی دستگاه فلوسایتومتر
به طور کلی اجزای اصلی یک دستگاه فلوسایتومتری را می توان به سه قسمت تقسیم نمود:
- سیستم Fluidics، در روش فلوسایتومتری برای بررسی سلولها باید آنها در یک صف و به صورت تکی درآمده و در سیال مناسبی به صورت معلق از مقابل پرتوی نور (لیزر) عبور نمایند. به طور کلی سیستم Fluidics، جریان آرامی از سلولها را به درون جریان حامل سریع (Sheath fluid) وارد میكند. مایع حامل، سلولها را در مركز لوله متمركز میكند، بنابراین سلولها به طور منظم و در یك مسیر مجازی به نقطه اندازهگیری منتقل میشوند. . این پدیده که در دستگاه فلوسایتومتر موجب ایجاد اطلاعات منحصربه فرد از یک ذره یا سلول می شود، به نام اثر هیدرودینامیک کانونی (Hydrodynamic focusing) خوانده می شود. سرعت جریان نمونه در فلوسایتومتری ۵ تا ۵۰ متر در ثانیه و امکان جمعآوری اطلاعات ۵۰۰۰ تا۵۰۰۰۰ سلول در هر ثانیه می باشد همچنین حجم مورد نیاز نمونه خون به طور معمول حدود ۱۰۰ میکرولیتر و یا کمتر است. این ویژگی ها فلوسایتومتری را به عنوان یک تکنیک فوقالعاده در مطالعات کلینیکی مطرح نموده است.
اثر هیدرودینامیک کانونی در ایجاد جریان تک سلولی در دستگاه فلوسایتومتر
- سیستم نوری (اپتیک)، این سیستم به طور معمول متشكل از یك یا چند منبع نوری (لیزر ویا Arc lamp) به همراه تعدادی عدسی، فیلتر و آشكارساز می باشد. عدسیها و فیلترها جهت متمرکز نمودن و انتقال نور منبع به نقطه اندازهگیری و نیز برای جمع آوری و هدایت سیگنال های نور پراكنده شده و نورفلورسانس ساطع شده از نقطه اندازهگیری به آشكارسازها به كار میروند.
تولید نور با یک طول موج و با اندازة نقطهای بسیار كوچك در منابع نوری لیزری نسبت به سایر لامپ ها بسیار با اهمیت است، زیرا هرچه نور متمرکزتر بوده و در فضای كوچكتری محدود شود، میزان برانگیخته شدن ذره و یا ماده فلورسانس متصل به ذره و یا سلول بیشتر خواهد بود. همچنین متمرکز بودن پرتوی نور سبب اطمینان از تابش نور به تنها یک ذره یا سلول در هر لحظه خواهد شد. در میان انواع لیزرها، لیزر آرگون با طول موج ۴۸۸ نانومتر بیشترین استفاده را دارد. علاوه بر این در دستگاههای فلوسایتومتر از لیزرهای دیودی با طول موج ۶۳۵ نانومتر نیز استفاده می شود.
در دستگاههای فلوسایتومتری برای شناسایی چندین سیگنال به طور همزمان انتخاب نوع و آرایش و محل قرارگرفتن فیلترهای نوری یکی از مسائل بسیار بااهمیت می باشد. در شکل فیلترهای Long pass به امواجی به طول موج های بالاتر از حد مورد نظر اجازه عبور می دهند. در حالی که فیلترهای Short pass به امواجی با طول موج های پایین تر اجازه عبور می دهند. فیلترهای band pass تنها امواجی با طول موج مخصوص و در یک طیف باریک از آن ها عبور می کنند. همه این فیلترها از طریق مکانبسم جذب نور از عبور نور جلوگیری می کنند.
انواع مختلف فیلترهای نوری
- بخش الکترونیک، شامل مبدل های سیگنال های نوری به سیگنالهای الکترونیک قابل پردازش توسط کامپیوتر می باشد. هنگامی که سیگنالهای نوری به الکترونیکی تبدیل شدند، بر اساس قالبی استاندارد به نام قالب استاندارد فلوسایتومتری (FCS) ، اطلاعات حاصل از سیگنال های الکترونیکی ذخیره می شوند و با استفاده از نرم افزارهای حاضر میتوانند برای جمعآوری اطلاعات و پردازش آنها، ترسیم نمودارهای یك، دو یا سه بعدی از اطلاعات و یا برای انجام محاسبات ریاضی و آماری بر روی اطلاعات به كار برده شوند.
آماده سازی سوسپانسیون سلولی نمونه
برای اینکه فلوسایتومترها با حساسیت بالایی قادر به ردیابی نور لیزر پراکنده شده یا فلورسانس نشر شده از یک سلول در میان انواع سلولها باشند، نیاز است که سلولها به صورت سوسپانسیون یکنواختی در محیط مایع درآیند. روش های آماده سازی سوسپانسیون نمونه بسته به نوع سلول مورد ارزیابی متفاوت می باشد. پس از تهیه سوسپانسیون مناسب، سلول ها به طور مستقیم با فلوروکروم ها و یا آنتی بادی های متصل به فلوروکروم نشاندار می شوند. میزان اختصاصی بودن آنتی بادی، غلظت آنتی ژن در سطح یا داخل سلول، مناسب بودن غلظت آنتی بادی مورد استفاده و به کار بردن کنترلهای مثبت و منفی مناسب در آنالیز سلولها، روش نشاندار کردن را تحت تاثیر قرار می دهد.
هر سلولی بر حسب نوع و تخصصی كه به عهده دارد مولكولهای مختص به خود را بیان میكند. اغلب زیر گروههای اصلی سلولهای موجود در خون انسان مارکرهای سطحی اختصاصی خود را بیان میکنند که میتواند به شناسایی آنها کمک نماید. مولكولهای سطحی سلولها تحت نام عمومی Cluster Differentiation) CD) می باشند و برای ردیابی آنها از آنتیبادیهای مونوكلونال كونژوگه با فلوروكروم استفاده میشود. برای مثال سلولهای T حاوی مولکو لهای CD3 در سطح خود هستند و با استفاده از مولکولهای CD4 و CD8 میتوان دو گروه مجزای این سلولها را شناسایی کرد.CD19 فقط در سلولهای B وجود دارد و CD56 و CD16 در سلولهای کشنده طبیعی (NK) یافت میشود.
حداقل حجم مورد نیاز از نمونه به مقدار سلولهای مورد نظر در میان انواع سلولهای موجود در نمونه نیز بستگی دارد و اگر درصد سلولهای مورد بررسی، نسبت به سایر سلولهای موجود پایین باشد لازم است ابتدا بخشی از سلولهای ناخواسته حذف شود. قطر سلولهای ارزیابی شده باید در محدوده ۱ تا ۳۰ میکرون باشد و فلوسایتومترهای معمولی برای ارزیابی ذرات کوچکتر از ۱میکرون حساسیت لازم را ندارند.
امروزه در دستگاه های فلوسایتومتر، مجموعهای از فنآوریهای گوناگون و نوین برای مطالعه سلولها و بررسی ساختار و محتوای آنها بكار گرفته شده است. در این روش حتی ذرات كوچكتر از ۰٫۱ میكرومتری قابل تشخیص بوده و آستانه رنگ سنجی آن حدود ۱۰۰۰ مولكول رنگ یا ۱۸-۱۰×۱ گرم رنگ به ازای هر سلول است.
طراحی و انجام صحیح آزمایش شامل انتخاب آنتیبادی مناسب و انتخاب فلوروكروم متناسب با غلظت و موقعیت آنتیژن، به كارگیری روش صحیح تهیة نمونه سلولی و تنظیم دقیق دستگاه نیازمند تجربیات و اطلاعاتی است كه باید فرد انجام دهنده آزمایش داشته باشد. انجام صحیح و دقیق این مراحل در پیشگیری از خطاهای مربوط به مرحلة جمعآوری اطلاعات و مرحلة آنالیز اطلاعات کمک کننده خواهد بود.
نمایش نتایج
بررسی انتخابی سلول های مورد نظر و حذف نتایج مرتبط با سلول های ناخواسته نظیر سلول های مرده و دبرمان، یکی از مهمترین اصول فلوسایتومتری است که Gating نام دارد.هر دستگاه فلوسایتومتری نرم افزار خاصی را برای دریافت، نمایش و آنالیز داده ها بر روی کامپیوتر دستگاه خود دارا می باشد. این نرم افزار نتایج نهایی آنالیز داده ها را به صورت نمودار نمایش خواهد داد. انواع مختلفی از نمودارها در فلوسایتومتری وجود دارند که همه بیانگر نمایش کمی بیان یک شاخص می باشند.
نمودار نقطه ای (Dot Plot):
در این نوع نمودار هر نقطه نشان دهنده ی یک ذره و هر جمعیت به صورت تجمعی از ذره ها به صورت فشرده یا کم تراکم دیده می شود. جایگاه این ذرات بر روی نمودار بر اساس شدت و ضعف سیگنال ایجاد شده توسط آن ها و دریافت این سیگنال توسط آشکار ساز می باشد.
نمودار تراکمی ( Density Plot ) :
در این نمودار تراکم نقاط که معرف جمعیت های سلولی هستند با رنگ های مختلف نشان داده می شود
نمودار نقشه ای (Contour Plot):
تجمع نقاط (سلول ها) به صورت خطوط نشان داده می شود و مانند نقشه های جغرافیا به نظر می آید.
نمودار هیستوگرام (histogram):
بر خلاف نمودارهای قبلی که همزمان دو پارامتر را مورد تجزیه و تحلیل قرار می دهند، در این نمودار سنجش یک پارامتر (فلورسانس نسبی شدت پراکندگی نور) بر روی محور X ها و تعداد ذرات (سلول ها) بر روی محور Y ها نمایش داده می شود.
آستانه (Threshold)
تعیین مقدار حداقل سیگنال، برای ثبت توسط آشكارساز، آستانه نام دارد. به این معنی که سیگنال هایی که مساوی و یا بیشتر از مقدار تعیین شده توسط کاربر هستند نمایش داده شوند یا به عبارتی فقط سیگنال هایی در آشکارساز ثبت شوند که مقدار آنها از آستانه بیشتر باشد.
اصلاح هم پوشانی نور ساطع شده (Compensation):
فلوروکروم ها رنگریزه هایی هستند که انرژی نور را در طول موج خاص دریافت و برانگیخته شده و آن را در یک طول موج بزرگتر و بالاتر تابش (نشر) می کنند. طیف نشری رنگ های فلورسانس بسیار وسیع است. در مطالعات فلورسانس چند رنگی ممکن است طیف نشری بعضی از فلورکروم ها با یکدیگر هم پوشانی داشته باشند. در این مطالعات باید در انتخاب فلوروکروم ها دقت نمود که به گونه ای انتخاب شوند که کمترین همپوشانی بین فلوروکروم ها وجود داشته باشد. با این وجود در موارد زیادی مشاهده شده که فلوروکروم های انتخابی با هم هم پوشانی دارند. در چنین مواردی برای رسیدن به نتایج صحیح باید این هم پوشانی را حذف نمود. عبارت Compensation در آنالیز داده های فلوسایتومتری به تصحیح هم پوشانی رنگ ها اشاره دارد. این عبارت که تحت عنوان همبستگی فلورسانس در آنالیز داده ها به کار گرفته می شود، درصد تداخل یک فلوروکروم در کانالی که به سنجش آن اختصاص نیافته است را محاسبه می کند. این امر در مواقعی که هم پوشانی بین فلوروکروم ها وجو دارد موجب بدست آوردن نتایج قابل اعتمادی می شود.
کاربرهای فلوسایتومتری
- تشخیص فنوتایپ، شناسایی و شمارش دقیق سلول ها (گیرنده های سطح سلولی یا اجزای سلولی)
- اندازه گیری فعالیت آنزیمی
- مطالعه فعالیت آپوپتوزی (مرگ ومیر سلولی)
- مشخص کردن محتوای اسید نوکلئیک سلول
- آزمایش های نفوذ کلسیم
- دسته بندی و جداسازی سلولی
آزمایشات قابل انجام:
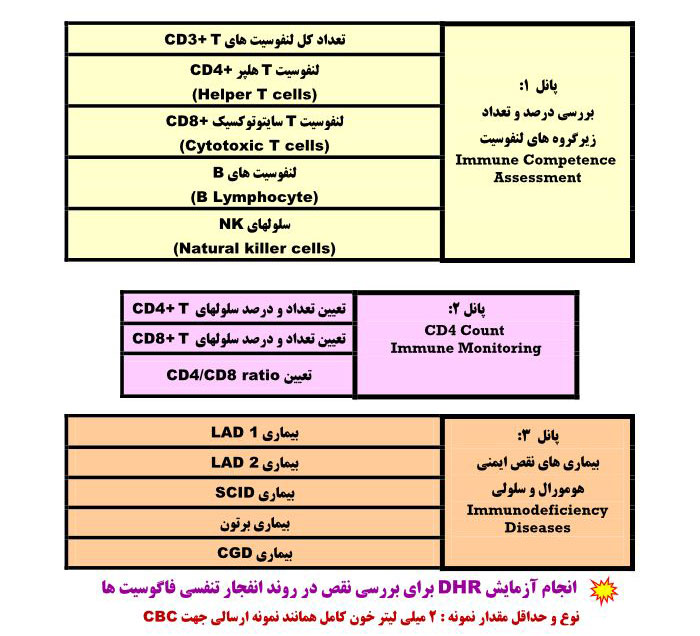
توجه:
- نمونه های مختلف از جمله آسپیره مغز استخوان ، خون محیطی و مایعات مختلف از جمله CSF ، مایع پلور و غیره برای انجام آزمایشات فلوسایتومتری کاربرد دارد.
- بهترین ضدانعقاد برای نمونه های خون محیطی و مغز استخوان EDTA می باشد
- حجم مورد نیاز برای انجام آزمایشات فلوسایتومتری ۲ میلی لیتر خون کامل همانند نمونه CBC
- آزمایش باید در کمتر از ۲۴ ساعت انجام شود و بهتر است بعد از انجام نمونه گیری نمونه بلافاصله به آزمایشگاه ارسال گردد.
- نمونه هایی که ۲۴ ساعت از نمونه گیری آن ها گذشته قابل پذیرش نمی باشند.
- از فریز کردن نمونه خودداری نمایید زیرا انجماد منجر به لیز سلولی شده و ارزیابی را غیر ممکن می سازد.
- نمونه باید در درجه حرارت اتاق (۲۰-۲۴ درجه سانتیگراد) به آزمایشگاه انتقال داده شود اما در صورت گرم بودن هوا و دور بودن فاصله تا آزمایشگاه در شرایط یخچال به آزمایشگاه انتقال داده شود.
منابع برگزیده:
- Flow Cytometry Protocols second Edition Edited by Teresa S.Hawley, Robert G.Hawley
- Flow Cytometry Principles and Applications Edited by Marion G. Macey, PhD
- Practical Flow Cytometry Fourth Edition HOWARD M. SHAPIRO