آزمایشات انعقادی
 انعقاد خون (Coagulation) فرآیندی است که موجب لختهشدن خون میشود. این فرایند از دو مسیر داخلی وخارجی موجب تبدیل فیبرینوژن به فیبرین، فعال شدن فاکتورهای انعقادی و تجمع پلاکتها میشود. انعقاد خون هر چند با لخته شدن خون موجب توقف خونریزی میشود و نقص این فرایند در بیماریهایی مانند هموفیلی کشنده چشمگیر است ولی انعقاد نابجای خون در ایجاد سکته قلبی و ایسکمی مغزی وآمبولی نیز نقش دارد.
انعقاد خون (Coagulation) فرآیندی است که موجب لختهشدن خون میشود. این فرایند از دو مسیر داخلی وخارجی موجب تبدیل فیبرینوژن به فیبرین، فعال شدن فاکتورهای انعقادی و تجمع پلاکتها میشود. انعقاد خون هر چند با لخته شدن خون موجب توقف خونریزی میشود و نقص این فرایند در بیماریهایی مانند هموفیلی کشنده چشمگیر است ولی انعقاد نابجای خون در ایجاد سکته قلبی و ایسکمی مغزی وآمبولی نیز نقش دارد.
مکانیسم انعقاد
مکانیسمهای لخته شدن با ایجاد آسیب در جدار رگ یا بافتهای اطراف، یا تماس خون با سلولهای آندوتلیال آسیب دیده و کلاژن آغاز میشوند. در هر مورد این عوامل منجر به تشکیل فعال کننده پروترومبین میشوند که این امر موجب تبدیل پروترومبین به ترومبین و مراحل بعدی انعقاد میگردد. به طور معمول فعال کننده پروترومبین از دو مسیر ایجاد می شود.
- مسیر خارجی
- مسیر داخلی
مسیر خارجی انعقاد(Extrinsic pathway)
در اثر صدمات جدار عروق، فاکتور نسجی وارد سیستم عروقی میشود. فاکتور نسجی قادر است با یک پروتئین پلاسمایی به نام فاکتور VII کمپلکس پایدار ایجاد نماید که نیاز به فسفولیپید و یون کلسیم می باشد. در نهایت کمپلکس مذکور موجب فعال شدن فاکتورX و IX میگردد.
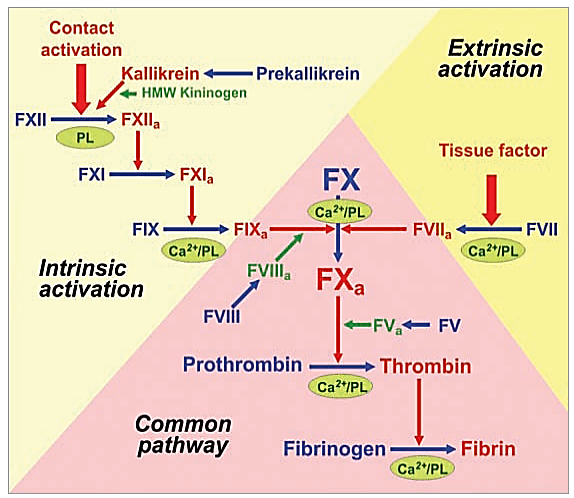
مسیر داخلی انعقاد(Intrinstic pathway)
در اثر صدمات بافتی و صدمه به سلولهای اندوتلیال عروقی، بافت کلاژن زیر این عروق در معرض دسترسی پلاکتها وفاکتورهای انعقادی قرار میگیرد که موجب فعالیت آنها میگردد. این مسیر از راه تماس با فعال شدن یکسری واکنش ها که مستلزم وجود فاکتورهای XII، XI، IX، VIII پره کالیکرین، HMW کی نی نوژن و فاکتور ۳ پلاکتی می باشد، شروع
می شود. سرانجام در این مسیر کمپلکسی از فاکتورهای IX فعال،VIII ، یون کلسیم و فسفولیپید پلاکتی باعث فعال شدن فاکتور x میگردد.
مسیر مشترک
پس از تبدیل فاکتور X به فاکتور Xa هر دو مسیر در یک مسیر مشترک قرار میگیرند. در ادامه فاکتورXa به کمک کوفاکتور Xa در حضور یون کلسیم و فاکتور ۳ پلاکتی (PF3) باعث تبدیل پروترومبین به ترومبین گردیده و ترومبین باعث تبدیل فیبرینوژن به فیبرین می شود. ترومبین همچنین به عنوان یک محرک فیزیولوژیک بسیار قوی برای فعال شدن پلاکتها عمل میکند. پلاکتها در حضور یون کلسیم ، پروترومبین را به ترومبین تبدیل میکنند و همین باعث افزایش مقدار ترومبین و در نتیجه شدت واکنش ها میگردد. نقطه پایان این واکنش ها ، ایجاد پلیمر فیبرین است. پایدار شدن نهایی لخته خون با فعال شدن فاکتور XIII یا همان فاکتور پایدار کننده فیبرین صورت میگیرد.
فیبرینولیز طبیعی
همزمان با تشکیل فیبرین انعقادی یک سیستم آنزیماتیک به منظور رفع لخته و بهبود جریان خون در عروق ضایعه دیده شروع به فعالیت می نماید. ترکیب اصلی این مکانیسم پلاسمینوژن و واسطه فیبرینولیز آنزیمی به نام پلاسمین می باشد. عمل پروتئولیتیک پلاسمین بر روی فیبرین یا فیبرینوژن منجر به تشکیل گروهی از قطعات پروتئین محلول به نام FDP یا FSP (Fibrin degradation or split products) خواهد شد. FDP از جریان خون توسط مکانیسم های کلیرانس در کبد، کلیه ها و سیستم رتیکولواندوتلیال خارج می شود.

عوامل انعقادی
فیبرینوژن (فاکتورI)
پروتئینی پلاسمایی که در مسیر مشترک انعقادی قرار دارد و هنگام انعقاد خون، بر اثر آزاد شدن و فعال شدن آنزیم ترومبین به رشتههای نامحلول فیبرین تبدیل میشود و در انعقاد خون نقش مهمی دارد. فیبرینوژن در کبد ساخته میشود و سطح خونی آن در شرایطی مانند بارداری و التهاب افزایش مییابد.
مقادیر طبیعی:
آقایان: ۳۷۵-۲۰۰ میلی گرم در دسی لیتر
خانم ها:۴۳۰ – ۲۰۰ میلی گرم در دسی لیتر
پروترومبین (فاکتور II)
پرو آنزیمی که در مسیر مشترک انعقادی عمل می نماید. بیوسنتز آن در کبد بوده و یکی از فاکتورهای مهم در انعقاد خون مناسب می باشد. پروترومبین در پلاسمای طبیعی با غلظت حدود ۱۵ میلی گرم در دسی لیتر وجود دارد.
آزمایش PT
- آزمایش زمان پروترومبین (PT) که گاهی INR نامیده می شود، آزمایش انتخابی برای ارزیابی مسیر خارجی و مسیر مشترک انعقاد و فاکتورهای X، VII،V، II و I میباشد.
- مقدار طبیعی آن ۱۴-۱۰ ثانیه می باشد.
- زمان انعقاد خون در بیماری کبدی، مصرف داروهای رقیق کننده خون،کمبود ویتامین K ، کاهش پروتئین های انعقادی افزایش می یابد. همچنین میزان آن در مصرف مکمل ویتامین K یا غذاهای حاوی ویتامین K و داروهای حاوی استروژن کاهش می یابد.
- استفاده از نسبت نرمالشدهی بینالمللی(INR) با تست PT برای بیمارانی که داروهای رقیقکنندهی خون وارفارین (کومادین) دریافتمیکنند، توصیه میشود.
- INR نسبتی است که اجازه میدهد تا نتایجآزمایشگاههای مختلف باهم قابلمقایسه باشند.
- مقدار طبیعی INR در افراد سالم برابر با ۱٫۱ و یا پایین تر است.
- اگر بیمار داروی ضدانعقاد مصرف کند، برای اطمینان از عملکرد دارو، پزشک باید میزان PT وINR فرد را بهطورمنظم کنترل نماید.
فاکتور III یا فاکتورنسجی
فاکتور نسجی (فاکتور III، ترومبوپلاستین) انعقاد خون را تسریع می نماید.این فاکتور در پدیده انعقاد بواسطه فعل و انفعالات با فاکتور VII در مسیر خارجی انعقاد عمل می نماید.
پرواکسلرین (فاکتور V ، Proaccelerin)
فاکتور V در فعال کردن پروترومبین در مسیر مشترک انعقادی مورد نیاز می باشد. این فاکتور در کبد ساخته شده و در پلاسمای بدون کلسیم ناپایدار و به سرعت توسط EDTA و اگزالات غیر فعال می شود.
پروکونورتین (فاکتور VII ، Proconvertin )
فاکتور VII یک سرین پروتئاز وابسته به ویتامین K سنتز شده در کبد است و جزئی از مسیر انعقاد خارجی است، که توسط زمان پروترومبین (PT) اندازه گیری می شود.نیمه عمر زیستی پلاسمایی فاکتور VII حدود ۳ تا ۶ ساعت است. کمبود این فاکتور در افراد مستعد منجر به خونریزی می گردد.
کاربرد بالینی:
- تشخیص نقص مادرزادی فاکتورVII انعقادی
- ارزیابی کمبود اکتسابی همراه با بیماری های کبدی، درمان با ضد انعقادی خوراکی و کمبود ویتامینK
- تعیین میزان ضد انعقاد وارفارین که با سطح پروتئینC مرتبط است.
- بررسی زمان پروترومبین طولانی شده.
مقادیر طبیعی:
بالغین: % ۱۸۰-۶۵
نوزادان تازه متولد شده و نوزادان نارس سالم به میزان % ۲۰=< افراد بالغ دارای فاکتور VII می باشند. در کودکان بیشتر از ۳ ماه سطوح فعالیت فاکتور VII به حدود مقادیر بزرگسالان می رسد.
توجه:
- بیماری کبدی، کمبود ویتامینK، و ضد انعقاد وارفارین می تواند باعث کاهش فعالیت فاکتورVII گردد.
- به طور کلی در افراد هتروزیگوت سطح فعالیت % ۵۰=> می باشد. افراد هموزیگوت به طور معمول سطح فعالیت %۲۰ درصد< و نوزادان سطوح فعالیت ۲۵٪=> را دارا می باشند.
- در کمبود فاکتورVII، تست PT غیر طبیعی و تست PTT طبیعی می باشد.
فاکتور VIII ، فاکتور ضد هموفیلی ( Factor VIII Activity Assay, Antihemophilic Factor)
فاکتور VIII پروتئینی است که در کبد و سایر بافت ها ساخته شده و نیمه عمر آن ۱۸-۹ ساعت است و در مسیر داخلی انعقاد مورد نیاز می باشد. در مسیر داخلی انعقاد خون کمپلکسی از فاکتورهای VIII و IX در ارتباط با یون کلسیم و فسفولیپید پلاکتی سرانجام باعث فعال شدن فاکتور x میگردد. کمبود این عامل انعقادی موجب بروز بیماری هموفیلیA میگردد.
کاربردهای بالینی:
- تشخیص بیماری فون ویل براند، زمانی که آنتی ژن و فعالیت فاکتور فون ویل براند همراه با فاکتور هشت اندازه گیری شود.
- تشخیص وضعیت نقص اکتسابی فاکتور VIII نظیر اختلالات عملکردی کبد، انعقاد داخل عروقی منتشر (DIC).
- بررسی زمان ترومبوپلاستین نسبی فعال طولانی شده.
توجه:
- آنتی بای دهای اختصاصی فاکتور VIII از شایعترین مهارکننده های انعقادی می باشند که می تواند منجر به خونریزی شدید گردد.
- به طور معمول بیمار ی کبدی موجب افزایش سطح فاکتور VIII می شود.
- کمبود مادرزادی فاکتور VIII ممکن است همراه با کمبود فاکتور پنج (V) رخ دهد.
- کمبود اکتسابی فاکتورVIII با اختلالات میلوپرولیفراتیو یا لنفوپرولیفراتیو ( بیماری فون ویل براند اکتسابی (در ارتباط می باشد. مهار کننده فعالیت فاکتور VIIIشامل حضور آنتی بادی بر ضد فاکتور VIII، شرایط پس از زایمان، انعقاد داخل عروقی ، فیبرینولیز و بیماری فون ویل براند می باشند که منجر به کاهش در مقادیر فاکتور VIIIمی گردند.
- فاکتورVIIIیک پروتئین بسیار ناپایدار است. نگهداری نامناسب نمونه ممکن است منجر به نتایج کاذب گردد .
- فاکتورVIIIبسیار مستعد به غیر فعال شدن پروتئولیتیک است، که موجب نتایج بالقوه منفی کاذب می شود.
- فعالیت فاکتورVIIIدر نمونه پلاسمای منجمد حتی در شرایط مطلوب پردازش و حمل و نقل، ممکن است ۱۰ تا ۲۰ درصد پایین تر از نمونه های تازه تهیه شده باشد. در صورت شرایط کمتر از حد مطلوب این اختلاف درصد ممکن است بیشتر باشد.
- فعالیت فاکتورVIIIدر پاسخ به تعدادی از عوامل، از جمله حاملگی، درمان با استروژن، استرس، بیماری، و غیره افزایش می یابد.
- اندازه گیری فاکتور هشت برای استنباط وضعیت حامل در زنان مظنون به حاملین ژن هموفیلیA مفید نیست. مگر آنکه درصد فعالیت کمتر از ۵۰٪ نرمال باشد.
- در بیماری فون ویلبراند میزان فاکتورVIII کاهش می یابد.
- در کمبود فاکتورVIII، زمان پروترومبین طبیعی و زمان ترومبوبلاستین نسبی غیر طبیعی می باشد.
مقادیر طبیعی: % ۲۰۰-۵۵
- به طور معمول نوزادان تازه متولد شده کامل یا نوزادان نارس سالم دارای فاکتور VIII طبیعی یا افزایش یافته|
می باشند.
فاکتور فون ویلبراند ( Von Willebrand factor)
یکی از پروتئینهای فاز حاد است که در هموستاز خونی نقش مهمی دارد. این پروتئین که برای چسبندگی پلاکتها ضروری است توسط لایه درون رگی و مگاکاریوسیتها و لایههای عروقی تولید میشود این فاکتور به عنوان پروتئین حامل فاکتور VII انعقادی عمل می نماید. کمبود این پروتئین (VWF) در بیماری فونویلبراند موجب اختلال انعقاد خون میشود. بیماری فونویلبراند شایعترین اختلال خونریزیدهنده ی ارثی است.
مقادیر طبیعی:% ۲۰۰-۵۵
فاکتور IX (Antihemophilic factor B or Christmas factor)
فاکتورIX یا فاکتور کریسمس، یک آنزیم سرین پروتئاز با وزن مولکولی حدود ۵۷ کیلو دالتون است که در کبد ساخته می شود. فاکتور IX جهت فعال شدن نیاز به ویتامین K دارد. نیمه عمر آن ۲۴-۱۸ ساعت می باشد و در مسیر داخلی انعقاد فعالیت
می نماید. مقادیر پلاسمایی آن مابین ۳ میکرو گرم در میلی لیتر است.
کاربردهای بالینی:
- تشخیص نقص فاکتورIX انعقادی به ویژه بیماری هموفیلی B
- ارزیابی اثر بیماری کبدی بر هموستاز
- بررسی زمان ترومبوپلاستین نسبی طولانی شده.
توجه:
- شدت هموفیلیB؛ به میزان فعالیت فاکتور IX بستگی دارد.
۵ تا ۲۵ درصد : هموفیلی خفیف
۱ تا ۵ درصد: هموفیلی متوسط
کمتر از ۱% : هموفیلی شدید
- در کمبود فاکتورIX، آزمایش PTT غیر طبیعی و PT طبیعی می باشد.
مقادیر طبیعی: % ۱۴۰-۶۵
- نوزادان تازه متولد شده کامل و نوزادان نارس سالم به میزان % ۲۰=< افراد بالغ دارای فاکتور VII می باشند. در کودکان بیشتر از ۳ ماه سطوح فعالیت فاکتور VII به حدود مقادیر بزرگسالان می رسد.
آزمایش PTT (زمان ترومبوپلاستین نسبی فعال شده)
- ازPTT برای پایش درمان با هپارین استفاده میشود.
- تست انتخابی برای ارزیابی مسیر داخلی و مشترک و فاکتورهای I, II, V, VIII, IX, X, XI و XII میباشد.
- ازPTT برای شناسایی مهارکننده های انعقادی مسیر داخلی و مشترک نظیر لوپوس آنتی کواگولانت و مهارکننده های فاکتور اختصاصی و غیر اختصاصی مانند آنتی فسفولیپیدها استفاده می شود.
- از علل افزایش PTT میتوان به کمبود فاکتورهای VIII، IX، XI و XII، وجود مهارکننده هایی مثل لوپوس آنتیکواگولانت ها یا مهارکننده های غیر اختصاصی نظیر ایمونوگلبولین مونوکلونال و مهارکننده های اختصاصی انعقاد اشاره کرد.
- از علل کاهش PTT می توان به بالا بودن میزان فاکتور VIII ناشی از بیماری حاد و مزمن یا التهاب، عدم نمونه گیری صحیح و جمع آوری نمونه اشاره نمود.
- مقدار طبیعیPTTه۳۸-۲۸ ثانیه است.
آزمایش زمان انعقاد فعال شده (Activated Clotting Time (ACT)) و زمان انعقاد خون کامل (CT)
ACT برای اندازه گیری تاثیر هپارین به عنوان یک ضدانعقاد طی آنژیوپلاستی قلبی، همودیالیز و جراحی بای پس قلبی ریوی استفاده می شود. این آزمایش همانندaPPT توانایی راه داخلی در شروع تشکیل لخته را با فعال کردن فاکتور XII اندازه گیری می نماید. استفاده از ACT در تشخیص مقدار مناسب پروتامین سولفات مورد نیاز در خنثی کردن اثر هپارین بعد از انجام جراحی و همودیالیز اهمیت بسیاری دارد. ACTتحت تأثیر فاکتورهایی نظیر هایپوترمی، رقیق شدن خون، تعداد و عملکرد پلاکت، کمبود فاکتورهای انعقادی می باشد. تزریق هپارین، سیروز کبدی، مصرف کومادین و مهارکننده های لوپوس موجب طولانی شدن زمان ACT می شوند.
مقادیر طبیعی:
زمان انعقاد خون کامل (CT):
آزمایش روی لام: ۶ – ۲ دقیقه
زمان انعقاد فعال شده (ACT):ه۱۲۰ – ۷۰ ثانیه
فاکتور X یا فاکتور Stuart-Prowr
فاکتور X سرین پروتئازی وابسته به ویتامین K که در کبد ساخته می شود. نیمه عمر آن ۴۸-۲۴ ساعت است. این فاکتور توسط فرآورده های هر دو مسیر انعقادی داخلی و خارجی فعال می شود. و به عنوان پروآنزیمی برای تشکیل پروترومبیناز در راه مشترک انعقاد نقش اساسی دارد.
کاربردهای بالینی:
- تشخیص نقص مادرزادی و اکتسابی فاکتور انعقادی X
- ارزیابی فعالیت هموستاتیک در بیماری کبدی
- بررسی زمان ترومبوپلاستین نسبی فعال شده و زمان پروترومبین طولانی شده
توجه :
- نقص مادرزادی فاکتور X نادر است.
- نقص اکتسابی فاکتور X در ارتباط با بیماری کبدی، درمان با وارفارین و کمبود ویتامین K می باشد.
- کمبود فاکتور X موجب طولانی شدن زمان PT و PTT
- نقص اکتسابی شایعتر از نقص مادرزادی می باشد.
مقادیر طبیعی: % ۱۵۰-۷۰
- نوزادان تازه متولد شده کامل و نوزادان نارس سالم به میزان % ۲۰-۱۵ =< افراد بالغ دارای فاکتور X می باشند. در کودکان بیشتر از ۳ ماه سطوح فعالیت فاکتور X به حدود مقادیر بزرگسالان می رسد.
- مقدار فاکتور X در افراد هموزایگوت %۲۵ > و در افراد هتروزایگوت % ۵۰-۲۵ می باشد.
فاکتور XI یا فاکتور پیش ماده ترومبوبلاستین، فاکتور ضد هموفیلی C
فاکتور XI انعقادی در کبد سنتز می شود و نیمه عمر بیولوژیکی آن ۶۰ تا ۸۰ ساعت است. فاکتورXI جزئی از مسیر داخلی انعقاد
می باشد زمانی که فعال شود فاکتور IX غیر فعال را فعال می کند. در کمبود فاکتور XI ممکن است زمان ترومبوپلاستین نسبی طولانی شود. کمبود این فاکتور فرد را مستعد به خونریزی خفیف می نماید. اما ارتباط ضعیفی میان سطح فعالیت این فاکتور و میزان خونریزی وجود دارد. کمبود مادرزادی فاکتور XIبروز نسبتا بالایی در میان جمعیت اشکنازی یهودی تبار (هموفیلیC) دارد.
کاربردهای بالینی:
- ارزیابی کمبود فاکتور XI
- تشخیص هموفیلی نوعC
- بررسی طولانی شدن زمان نسبی ترومبوپلاستین فعال شده
توجه:
- کاهش میزان فاکتور XI ارتباط معنی داری با خطر خونریزی ندارد.
- نقص اکتسابی فاکتور XI با بیماری کبدی و به ندرت مهارکننده های انعقادی مرتبط می باشد.
- در کمبود فاکتورXI ، زمان پروترومبین طبیعی (PT) و زمان ترومبوبلاستین نسبی غیر طبیعی ( PTT) می باشد.
- مقدار فاکتور XI در افراد هموزایگوت %۲۰ > و در افراد هتروزایگوت % ۶۰-۲۰ می باشد.
مقادیر طبیعی: % ۱۵۰-۵۵
- نوزادان تازه متولد شده کامل و نوزادان نارس سالم به میزان % ۱۰ =< افراد بالغ دارای فاکتور XI می باشند. در کودکان بیشتر از ۳ ماه سطوح فعالیت فاکتور XI به حدود مقادیر بزرگسالان می رسد.
فاکتور XII یا Hageman factor
فاکتور XII در کبد ساخته شده و دارای نیمه ۵۰-۴۰ ساعت می باشد. این فاکتور بر اثر تماس با سطح خارجی فعال می شود. فاکتور XII در مسیر داخلی انعقاد و سیستم فیبرینولیز نقش دارد.
کاربردهای بالینی:
- ارزیابی کمبود فاکتور XII
- بررسی طولانی شدن زمان نسبی ترومبوپلاستین فعال شده
توجه:
- نقص اکتسابی فاکتور XII با بیماری کبدی، سندرم نفریتیک و لوکمی گرانولوسیتیک مزمن مرتبط می باشد.
- مقدار فاکتور XII در افراد با نقص هموزایگوت مادر زادی %۲۰ و در افراد با نقص هتروزایگوت مادرزادی % ۵۰-۲۰ می باشد.
- کمبود سایر پروتئین های فعال کننده تماسی (پره کالیکرین و کی نونوژن) می تواند موجب طولانی شدن زمان PTT گردد اما باعث خونریزی نگردد.
مقادیر طبیعی: % ۱۸۰-۵۵
- نوزادان تازه متولد شده کامل و نوزادان نارس سالم به میزان % ۲۰-۱۵ =< افراد بالغ دارای فاکتور XII می باشند. در کودکان بیشتر از ۳ ماه سطوح فعالیت فاکتور XII به حدود مقادیر بزرگسالان می رسد.
فاکتور XIII یا fibrin-stabilizing factor
این فاکتور پروآنزیمی است که توسط ترومبین فعال شده و موجب ایجاد پیوندهای کووالان پایدار در درون رشته های فیبرین می شود. نیمه عمر این فاکتور ۱۲-۳ روز است. این فاکتور در بهبودی زخم ها ممکن است نیاز باشد.
کاربردهای بالینی:
- کمبود این فاکتور می تواند در تشخیص خونریزی های شدیدی بکار رود.
- درمان و كنترل خونريزي، و پيشگيري از خونريزي ضمن جراحي و كمك به بهبود زخمها.
مقادیر طبیعی: % ۵-۲
فاکتورهای سیستم کینین
دو ترکیب از سیستم پلاسمایی کینین به نام های پره کالیکرئین (Prekallikrein) و کینینوژن (High Molecular Weight Kininogen) در مسیر داخلی انعقاد نقش اساسی دارند. سیستم کینین یک آبشار آنزیمی میباشد و زمانی آغاز میگردد که فاکتور انعقادی با نام فاکتور XII به دنبال آسیب بافتی و اندوتلیوم عروق فعال شود. فاکتورهاگمن (XII) فعال متصل به سطح، پرهکالیکرئین (PK) را با برش پروتئولیتیک به کالیکرئین فعال تبدیل میکند. برای این عمل کینینوژن با وزن مولکولی بالا (HMWK) به عنوان کوفاکتور لازم میباشد. کالیکرئین فعال، خود سبب فعال شدن مقادیر بیشتری از فاکتور XII میشود. از طرف دیگر کالیکرئین سبب آزاد شدن برادیکینین از کینینوژن باوزن مولکولی بالا (HMWK) میشود. فعال شدن این سامانه موجب افزایش نفوذپذیری عروق، التهاب، اتساع عروقی و درد میشود.
مقادیر طبیعی :
پره کالیکرئین:۴۵-۱۵ میکروگرم در میلی لیتر
کینینوژن: ۱۵ ± ۹۲ میکروگرم در میلی لیتر
پروتئین C و Sه( Protein C, S)
پروتئین C یک پروآنزیم ضد انعقادی وابسته به ویتامین K می باشد که در کبد ساخته شده و نیمه عمر آن ۱۰-۶ ساعت است. پروتئین C در حضور کوفاکتور سلول اندوتلیال (ترومبومودولین) فعال می شود و پروتئین C فعال شده دارای فعالیت آنزیمی را می سازد. پروتئین C فعال شده به عنوان یک ضد انعقاد، اشکال فعال فاکتورهای V و VIII را غیر فعال می کند. همچنین این پروتئین با غیر فعال کردن مهارکننده پلاسمینوژن فیبرینولیز را افزایش می دهد. پروتئین S گلیکو پروتئینی پلاسمایی وابسته به ویتامین K می باشد که در کبد سنتز شده و به عنوان کوفاکتور پروتئین C عمل می کند.
کاربرد بالینی:
- به عنوان یک آزمون اولیه برای ارزیابی بیماران مشکوک به داشتن نقص مادرزادی پروتئینC، نظیرکسانی با سابقه شخصی یا خانوادگی ترومبوز عروقی.
- تشخیص و تایید نقایص مادرزادی پروتئینC هتروزیگوت نوع یک (فعالیت و مقدار پروتئین C کاهش می یابد) و نوع دوم (فعالیت کاهش یافته اما مقدار طبیعی است).
- تشخیص و تأیید کمبود پروتئینC هموزیگوت مادرزادی
- شناسایی کاهش اکتسابی عملکرد پروتئینC به سبب اثرات ضدانعقاد خوراکی، کمبود ویتامین K، بیماری کبدی، انعقاد و فیبرینولیز داخل عروقی.
توجه:
- کمبود ویتامین K، شوک سپتیک، انعقاد منتشر داخل عروقی،آمبولی ریه، بیماری کبدی، زایمان زودرس، التهاب حاد، بیماری خود ایمنی، ترومبوز حاد و تجویز وارفارین موجب کمبود این پروتئین ها می شوند.
- آزمایش پروتئینCو فعالیت پروتئین s باید همزمان بررسی گردد، زیرا ممکن است علت کاهش فعالیت پروتئین C، کمبود پروتئین s باشد. در صورت مشاهده کاهش فعالیت پروتئین C، مقاومت به پروتئین C ( وجود فاکتور پنج- لیدین) نیز باید آزمایش شود.
- فعالیت ضد انعقادی پروتئین C فعال شده با پروتئین S افزایش می یابد.
- کمبود پروتئینC در درمان با ضد انعقاد هپارین مشاهده می شود.
- بارداری یا استفاده از هورمون های جنسی اگزوژن با کاهش پروتئین های C و S همراه است.
- مبتلایان به شکل هتروزیگوت پروتئینC به طور معمول تا پس از بلوغ ممکن است تشخیص داده نشوند.
مقادیر طبیعی:
بالغین: (پروتئینC):ه %۱۵۰ – %۷۰
- نوزادان تازه متولد شده کامل و نوزادان نارس سالم به میزان % ۵۰-۱۵ افراد بالغ دارای پروتئین C می باشند.
(پروتئین S) :ه %۱۳۰ – %۶۰
فعالیت پروتئین C ممکن است تحت تاثیر عوامل زیر قرار گیرد:
- هپارین (هپارین شکسته نشده): ۴U/ml<
- هپارین (با وزن مولکولی کم): ۲U/ml <
- هموگلوبین: ۵۰۰mg/dl <
- بیلی روبین: ۲۱mg/dl
- تری گلیسرید : ۸۹۰mg/dl <
آنتی ترومبین III (Antithrombin III)
گروهی از پروتئینهای پلاسما هستند که مهارکننده انعقاد خون میباشند. این پروتئینها توسط کبد تولید شده و وارد خون میشوند و سه نوع می باشند. آنتی ترومبین III با اتصال به ترومبین، ترومبین را غیر فعالکرده و مانع تبدیل فیبرینوژن به فیبرین میگردد. نیمه عمر آنتیترومبین در پلاسما سه روز است. اختلال آنتی ترومبین که به دو صورت ارثی و اکتسابی اتفاق میافتد باعث ایجاد ترومبوزهای داخل عروقی میگردد. یکی از آزمایشهای مهم در افراد دچار ترومبوز عروقی و سقطهای مکرر جنین، بررسی آنتی ترومبین خون از نظر کمی و کیفی میباشد.
مقادیر طبیعی: % ۱۳۰-۸۰
نوزادان تازه متولد شده کامل و نوزادان نارس سالم به میزان % ۴۰-۳۵ =< افراد بالغ دارای آنتی ترومبین III می باشند. در کودکان بیشتر از ۳ ماه سطوح فعالیت این فاکتور به حدود مقادیر بزرگسالان می رسد.
آلفا دو ماکروگلوبین (Alpha-2-Macroglobulin)
یکی از پروتئینهای بزرگ پلاسما از گروه گلوبولینها است که توسط کبد تولید میشود. این پروتئین در بین پروتئینهای خون (بجز پروتئینهای سیستم ایمنی) بزرگترین اندازه را دارد و هرچند بیشتر آن در کبد تولید میشود ولی به مقدار کم بصورت موضعی توسط ماکروفاژها، فیبروبلاستها و قشر غده فوق کلیوی تولید میشود. آلفا دو ماکروگلوبولین انسانی پروتئینی با چهار زنجیر پلی پپتیدی میباشد که به عنوان یک مهارکننده پروتئاز و یک پروتئین فاز حاد عمل میکند. این پروتئین با مهار پلاسمین و کالیکرئین موجب توقف فیبرینولیز میشود. همچنین با مهار ترومبین از انعقاد خون جلوگیری میکند. مقدار پلاسمایی آن در موارد دفع شدید پروتئین مانند سندرم نفروتیک، سیروز کبدی و دیابت افزایش مییابد.
مقادیر طبیعی: ۲۸۰-۱۰۰ میلی گرم در دسی لیتر
آزمایش BTه(Bleeding time)
جهت بررسي عملکرد پلاكتي به كار مي رود. این آزمایش اغلب قبل از عمل جراحی به منظور اطمینان از کارایی کافی هموستاز بر روی بیماران، انجام می شود . آزمایش BT در بیماری فون ویلبراند و سایر اختلالات عملکردی ارثی پلاکتی و همچنین در اورمی و ماکروگلوبولینمی افزایش مییابد. در مجموع این آزمایش برای تشخیص یا پیشگویی خطر خونریزی مناسب و قابل اعتماد نمیباشد.
این آزمایش به دو روش Duke (برش بر روی لاله گوش یا نوک انگشت) و روش Ivy ( در ناحیه بازو و ایجاد برش روی ساعد) انجام می گردد.
مقادیر طبیعی:
(روش lvy): 9- 2 دقیقه (در نوزادان کوتاهتر است)
روش(Duke ): 3- 1 دقیقه
توجه:
- حساسیت و اختصاصیت این آزمایش پایین است. شمارش پلاکت زیر۱۰۰۰۰۰ در میلی لیتر، هماتوکریت پایین، مصرف آسپرین و سایر داروهای مهارکننده ی پلاکتی سبب افزایش BT میگردند. عوامل مختلفی نظیرضخامت پوست، درجه حرارت بدن، خصوصیات عروق خونی، جهت ورود تیغ لانست (افقی یا عمودی) و محل شکاف می توانند با انجام آزمایش تداخل نمایند.
- كاهش دماي بدن،مصرف دسموپرسین و اریتروپویتین مدت زمان این آزمایش را کاهش می دهد.
- آنتیکوآگولانتها، دکستران، ایندومتاسین، سالیسیلاتها، استرپتوکیناز، آلوپورینول، بعضی آنتیبیوتیکها، هالوتان، NSAIDs، اوروکیناز و وارفارین ممکن است BT را طولانی کنند.
آزمایشات قابل انجام:
Coagulation Tests
- PT (Prothrombin time)
- APTT (Activated Partial Thromboplastin Time)
- CT (Clotting time)
- BT (Bleeding time)
- Plasma Protein-C assay
- Plasma protein-S assay
- Plasma anti-thrombin III
- Factor V Leiden (APC-R)
- Plasma fibrinogen level
- Lupus Anticoagulant (Circulating Anticoagulant, CAC)
- dRVVT (Dilute Russell’s Viper Venom Time) mixing study
- Anti-Prothrombin (screen)
- Anti-β۲ glycoprotein-I (IgG & IgM)
- FDP plasma(Fibrin Degradation Products)
- Fibrin D-Dimer assay(Fibrin Degradation Fragment)
- Anti-Phospholipid (IgG & IgM)
- Anti-Cardiolipin (IgG & IgM)
منابع برگزیده:
- HENRY’S Clinical Diagnosis and Management by Laboratory Methods 22 nd EDITION Richard A. McPherson, MD -2011
- Mosby’s Manual of Diagnostic and Laboratory Tests, 4th Edition By Kathleen Deska Pagana, PhD, RN and Timothy J. Pagana, MD, FACS
- https://en.wikipedia.org
- https://fa.wikipedia.org
- http://lab.behdasht.gov.ir/test/printTest/64